Megatrend Biotech: Was Gentechnik und Nano-Roboter bald können – und was nicht

Forscherin Helena Escobar füttert eine ihrer Zellkulturen in einem sterilen Schrank mit einer Nährflüssigkeit.
Die genmanipulierten Zellen werden so vermehrt und können später an Mäusen mit einer – ebenfalls durch -Genmanipulation -verursachten – Erbkrankheit getestet werden. (Foto: t3n)
Irgendwie hatte man sich die Milliroboter dann doch anders vorgestellt. Winzig, natürlich, aber vielleicht eher wie das geschrumpfte U-Boot aus dem 1960er-Jahre-Science-Fiction-Film Fantastic Voyage. Der Roboter, der stattdessen in der Petrischale liegt, ist überraschend einfach: ein flaches Rechteck aus schwarzem, biegsamem Kunststoff, anderthalb Millimeter lang, einen Millimeter breit. Erst als der Wissenschaftler Wenqi Hu einen Magneten unter die Schale hält, krümmt sich das schwarze Plättchen und rutscht nervös auf dem durchsichtigen Boden umher. Wenn Wenqi mit einer Kupferdraht-Spule ein gesteuertes magnetisches Feld erzeugt, passiert mit dem Plättchen aber einiges mehr: Wenqi kann es springen, sich kugeln oder sogar kriechen lassen, wie eine Raupe. In Zukunft soll es diese Bewegungen mitten im menschlichen Körper vollführen können – unterwegs im Magen und Verdauungstrakt.
Das, woran Wenqi Hu und Kollegen am Max-Planck-Institut für Intelligente Systeme in Stuttgart basteln, könnte nicht weniger sein als die Zukunft der Medizin. Die Forscher denken in kleinen Dimensionen, aber mit großen Visionen: Roboter in der Blutbahn, Gentherapien für unheilbare Krankheiten. Gewebe, das gedruckt werden kann. Das alles scheint mit der Computerisierung der medizinischen Forschung in greifbare Nähe gerückt: Schon 2016 hat Microsoft ein Machine-Learning-Tool namens Azimuth veröffentlicht, das Forschern dabei hilft, Gene präzise zu manipulieren. Vor Kurzem veröffentlichte das Unternehmen ein Tool, das die sogenannten Off-Targets, also die Nebenwirkungen der Genmanipulation, mithilfe einer KI minimiert. Roboterforscher wie Wenqi Hu schlagen Brücken zwischen Elektrotechnologie und der synthetischen Biologie, sie entwerfen sich Zellen als Werkzeuge. Convergence nennt man das im Silicon Valley, wenn plötzlich die Erkenntnisse aus ehemals unverwandten Disziplinen zusammenfließen. Und Convergence findet auch in Deutschland statt. Biotech-Einhörner wie die Mainzer Firma Biontech arbeiten mittlerweile eher wie Softwareentwickler: Neue Genstrukturen für Zellen, die Krankheiten bekämpfen sollen, werden dort am Computer entworfen. Der enorme Fortschritt bei Hardware und Software macht es möglich, die dafür nötigen komplexen Berechnungen überhaupt durchzuführen. Und bei Biodruckern wie dem Berliner Startup Cellbricks fragt man sich schon, ob man es eher mit einem Biotech-Labor oder mit 3D-Druck-Ingenieuren zu tun hat.

Halb Labor, halb Werkstatt: In diesem Raum baut und testet Wissenschaftler Wenqi Hu seine biegsamen Milliroboter. Mit der magnetischen Kupferspule auf dem Tisch bringt er sie in Bewegung. (Foto: t3n)
In aufgeregten Artikeln klingt es so, als wäre sie jetzt Realität, die Science-Fiction-Medizin: „Designerbabys sind nicht futuristisch, sie sind schon da“ und „Der Versuch, Lungen zu drucken und ihnen mit Stammzellen Leben einzuhauchen“ überschreibt die MIT Technology Review ihre Artikel. Dazu gießen Tech-Investoren hunderte Millionen US-Dollar ins Biotech-Feuer: Biontech etwa sammelte Anfang des Jahres 270 Millionen Dollar in einer Serie-A-Investmentrunde ein. Ist die Science-Fiction-Medizin so nah wie sie scheint oder nur ein Sturm in der Petrischale?
Kleine Roboter in unseren Blutbahnen
Wenn man Wenqi Hu in seinem Labor am Max-Planck-Institut auf dem Stuttgarter Uni-Campus fragt, wann sein Roboter das erste Mal durch einen echten Magen kriecht, zuckt er mit den Schultern. In fünf bis zehn Jahren, ist die offizielle Schätzung des Instituts. Wenqi wirkt dabei nicht, wie man sich einen klassischen Wissenschaftler vorstellen würde: Er trägt einen schwarzen Pulli, Jeans und bunte Nike-Sneaker. Vor ihm steht ein Dell-Laptop, auf einer Werkbank liegen ein paar Inbusschlüssel und verkabelte Platinen. Vielleicht macht Unkonventionalität gute Forschung. Der Geniestreich seines Roboters ist, dass er eigentlich kein Roboter ist: Statt aus winzigen Scharnieren und Motoren zu bestehen, ist das weiche Kunststoffplättchen nur magnetisch. „In einem Menschen könnte man den Roboter mit dem Magnetfeld eines Magnet-Resonanz-Tomografen (MRT) steuern“, erklärt Wenqi. Das Max-Planck-Institut plant schon die Anschaffung: „Kleinere Roboter sind kein Problem“, sagt er, „die eigentliche Herausforderung ist die Steuerung von außen.“ Wenqis Arbeit hat mit klassischer Medizin nur noch wenig zu tun. Er ist eher Physiker oder Ingenieur, der an einer sehr komplizierten Steuerungsmaschine arbeitet.
Wenn man über die Gänge des Instituts schlendert, hat man nicht das Gefühl, in einer Forschungseinrichtung zu sein. Menschen trinken Kaffee in Sitzecken, zeigen sich Präsentationen. Auf dem Campus gibt es auch eine Kita und einen Kindergarten. Ein paar Gänge von Wenqis Laborwerkstatt entfernt sitzt Metin Sitti, der Direktor der Abteilung für Physische Intelligenz, in einem sonnigen Eckbüro am Schreibtisch, schaut herüber auf einen Bildschirm, groß wie ein Türblatt. Neben der Tür lehnt ein Fahrrad an einem Whiteboard mit Skizzen, Zahlen und, auf Kniehöhe, ein bisschen Malerei seiner Kinder. Auf der Fensterbank stehen Mitbringsel aus Japan. Dinge, die er während seiner Karriere als Robotiker rund um die Welt eingesammelt hat. In Istanbul, Tokio, Berkeley und Pittsburgh.
„Wir verfolgen hier zwei Ansätze“, erklärt Sitti. „Der erste: Wie bei Wenqis Roboter machen wir die komplexen Dinge wie Steuerung und Energie außerhalb des Körpers – zum Beispiel mit einem MRT. Wir arbeiten an smarten Materialien, weichen Magneten zum Beispiel. Die können ihre Form ändern, kommen sicher an schwierige Orte, können Medikamente freigeben, ein Blutgefäß blockieren und damit eine Blutung stoppen. Man könnte sie auch von außen erhitzen und Krebszellen damit töten.“ So weit, so technisch. Den zweiten Ansatz nennt Sitti den biohybriden Ansatz. Und da ist man mitten in der Convergence, bei der die Grenzen von Robotik und Biochemie verschwimmen: „Wir nehmen ein Bakterium oder eine spezielle Alge aus der synthetischen Biologie als Antrieb und verbinden sie mit einer bestimmten Zelle.“ Wenn Sitti über Biologie redet, klingt es, als rede er von elektrotechnischen Bauteilen: „Rote Blutzellen können wir mit einem Medikament füllen.“ Sitti und sein Team arbeiten mit Bakterien, die ein anderes Institut für sie entworfen hat. Einige davon, so Sitti, können etwa darauf programmiert werden, Krebszellen anzusteuern: „Als ich Vorträge über synthetische Biologie gehört habe, dachte ich: ‚Wow, die machen ja Mikrorobotik‘. Aus dieser Perspektive ist eine Zelle auch eine Mikromaschine, ein Roboter.“
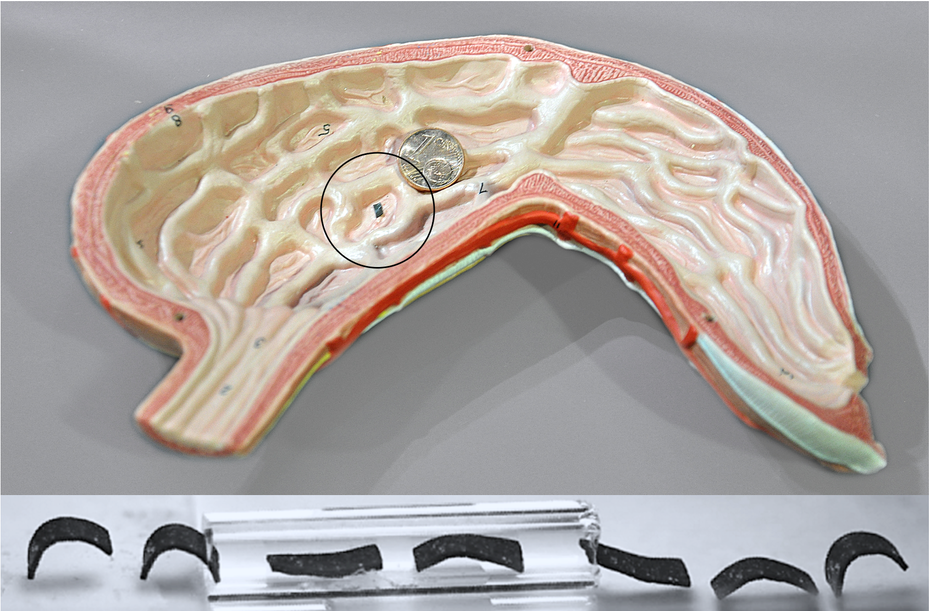
Der Milliroboter (im schwarzen Kreis) ist klein genug, um sich in einem Magen zu bewegen, Medikamente zu transportieren oder Tumore zu bekämpfen. Im unteren Bereich ist ein Bewegungsablauf des Milliroboters zu sehen. (Foto: Jan Vollmer, Abbildung: Max-Planck-Institut für Intelligente Systeme)
Die Produktion der Zellroboter, die im Institut Mikroschwimmer genannt werden, findet ein Stockwerk höher statt. Der junge Forscher Johannes Sachs steht da und starrt durch eine Schutzbrille in ein ofenähnliches Gerät: Oben ist ein Silicium-Waver eingespannt, eine untertassengroße spiegelglatte Scheibe, wie sie auch für die Produktion von Computerchips genutzt wird. Wenn der Ofen an ist, verdampft unten ein kleines Stück Gold und lagert sich, in Form von Mikrospiralen, auf dem Waver ab. Die winzigen Spiralen können mit den Bakterien und Zellen verbunden und in einem Körper eingesetzt werden: „Wir können sie auch magnetisch von außen steuern. Wenn die Schwimmer den Zielbereich erreichen, wird die Substanz mit einer anderen Fernsteuerung freigegeben“, erklärt Sitti in seinem Büro.
„Als ich Vorträge über synthetische Biologie gehört habe, dachte ich: ‚Wow, die machen ja Mikrorobotik‘.“
Metin Sitti will mit den Ergebnissen aus dem Institut ein Startup gründen. Am Institut führt er Machbarkeitsstudien durch, doch der Weg von einer Studie bis zu klinischen Tests ist weit – und für eine Forschungsgruppe allein kaum zu bewältigen. „Dafür braucht man einen Unternehmenspartner, der das Gerät herstellt und von der Arzneimittelbehörde prüfen lässt“, erklärt Sitti. Anfragen von Investoren gebe es bereits. Aber auch mit einem Startup brauchen Sittis Visionen noch Zeit. „Es wäre mein Traum zu sehen, wie die Millimaschinen medizinische Funktionen in Menschen erfüllen, bevor ich in Rente gehe“, sagt er.
Von Genscheren und Designerbabys
Eines der Felder, auf dem sich neben der Robotik in der Medizin am meisten tut, ist die Gentechnik. Der Agro-Chemie-Konzern Monsanto vertreibt zwar schon seit 1996 genmanipulierten Mais und auch das komplexere menschliche Genom gilt seit 2003 als entschlüsselt, aber bis vor Kurzem brauchte noch jede einzelne Manipulation eines Genoms jahrelange Forschung. Der Flaschenhals des Prozesses war, eine Substanz zu entwickeln, die gezielt eine bestimmte Sequenz aus dem Genom herausschneidet, damit sie ersetzt werden kann. 2012 veröffentlichte ein Team um die Französin Emmanuelle Charpentier ein Papier zu einer Methode, die sich CRISPR-Cas9 nennt und die das aufwendige Schneiden und Manipulieren an ein Enzym auslagert.
Den Wissenschaftler Jacob Corn, einer der Pioniere auf dem Gebiet des Gen-Editing, erreicht man per Skype in seinem Büro in der Bay Area in San Francisco. Corn hat dort an der UC Berkeley geforscht und bereitet gerade seinen Umzug an die ETH Zürich vor. Obwohl es während des Gesprächs in San Francisco sieben Uhr morgens ist, wirkt Corn wach. Er redet so schnell, als würde jemand die Audiospur mit 1,5-facher Geschwindigkeit abspielen: „Experimente, die früher ein Jahr gebraucht haben, dauern jetzt einen Tag“, erläutert er und lächelt. „Mit den alten Methoden war es wie beim Schreiben auf einer Schreibmaschine. Wenn man einen Fehler gemacht hat, musste man die ganze Seite noch mal schreiben. Mit CRISPR ist es wie in Word. Du schreibst was, du markierst was, du änderst es.“
„In den nächsten 15 Jahren werden wir noch keine Krankheiten heilen können.“
Als das Verfahren CRISPR, die Genschere mit Enzym, 2015 als Durchbruch der Gentechnik Schlagzeilen gemacht hat, wirkte es so, als sei jetzt alles möglich. Das Genom war ja schon seit 2003 entschlüsselt, jetzt konnte man es nach Belieben manipulieren und programmieren. Plötzlich schien die Frage nicht mehr zu sein, „Was geht mit Gentechnik?“, sondern „Wo sollten wir lieber vorsichtig sein?“. Wenn man Jacob Corn nach Designerbabys fragt, also der Möglichkeit, gezielt in das Erbgut menschlicher Embryonen einzugreifen und es zu manipulieren, hält er inne und atmet ein und aus, als müsse er sich kurz beruhigen: „Das wurde massiv überverkauft.“ Für Corn stellt sich diese Frage nicht. Er selbst arbeitet mit seinem Team noch daran, zu verstehen, was eigentlich genau passiert, wenn Enzyme Gene schneiden. „Es wird immer klarer, dass wir eigentlich noch nicht ganz verstehen, wie CRISPR als Werkzeug funktioniert. Stell dir vor, du baust ein Haus. Du hast einen neuen Hammer, aber bei jedem zehnten Schlag macht der Hammer ein komisches Geräusch und alle Nägel kommen wieder raus. Wir versuchen herauszufinden, wie diese neuen Hämmer und Nägel eigentlich funktionieren.“ Wenn CRISPR-Spezialist Corn über die Genschere redet, klingt es wesentlich komplexer als in der anfänglichen Alles-ist-möglich-Euphorie. Neue Technologien werfen eben auch neue Probleme auf. Erst im vergangenen Sommer machten Berichte von Genomvandalismus die Runde: Fälle, in denen das CRISPR-Verfahren Teile der DNS kaputtgemacht hatte.
Aber auch Jacob Corn lassen die theoretischen Möglichkeiten nicht kalt. „Genetische Therapien sind ein riesiges Ding“, sagt er. „Genetische Krankheiten konnte man in der Geschichte der Menschheit noch nie heilen. Die aktuell beste Behandlung für Muskeldystrophie ist ein Rollstuhl. Wenn Gentherapien in zehn oder 20 Jahren funktionieren, wird es sein wie die Erfindung des Antibiotikums: Wenn du davor eine Infektion hattest, konntest du nichts machen, du bist eben gestorben. Und dann, plötzlich, konnte man Penicillin nehmen. Ein Riesensprung für die Menschheit.“

Für seinen ersten Zelldrucker hat Lutz Kloke, Gründer vom Startup Cellbricks, deutschlandweit alte HP Deskjet 500 Drucker ersteigert. Deren Düsen waren groß genug, damit Zellen hindurchpassten. Einen anderen Entwurf für seine Doktorarbeit in Pharmazie (im Bild) baute Kloke aus Holz. Sein aktueller Drucker zieht die gedruckten Objekte aus Biotinte. (Foto: t3n)
An der Berliner Charité, auf dem Campus im Stadtteil Wedding, sitzt der Berliner Genforscher Stefan Mundlos an einem großen Schreibtisch. In einer Ecke des Büros lehnt ein City-Roller, mit dem Mundlos gelegentlich zwischen den Labors der altehrwürdigen Klinik hin und her flitzt. Für die Patienten der Charité analysieren Mundlos und sein Team Proben auf genetische Defekte. Er will wissen, warum und wie eine Zelle einer bestimmten Funktion nachkommt oder auch nicht: „Im Moment zählen wir 6.000 seltene Erkrankungen. Darunter sind 3.000 bis 4.000 Genmutationen, die bekannt sind. Zu Beispiel kam neulich eine Patientin mit extremer Gelenkbeweglichkeit. Sie konnte den Daumen bis zum Handgelenk biegen und dieses und auch andere Gelenke aus- und wieder einrenken. Das verursacht große Schmerzen. Mit einer genetisch gesicherten Diagnose können wir Eltern sagen, ob weitere Kinder gefährdet sind, und wie sich die Erkrankung entwickeln könnte.“ Ohne Bioinformatik, so Mundlos, wäre das alles nicht machbar. „Die Bedeutung der Verfahren wird immer weiter steigen,“ sagt er.
Fragt man Mundlos nach Designerbabys, winkt er ab: „Technisch funktionieren diese Methoden nie 100-prozentig“, erklärt er. „Ich kann mir nicht vorstellen, wie das als medizinisches Anwendungsverfahren durchkommt.“ In das Erbgut einzugreifen, um einen optimierten Menschen zu schaffen, so Mundlos, sei auch ein ganz anderes Kapitel voller Komplexität: „Wenn man fragt, was wäre das, was ein solcher Mensch haben sollte?‘, dann sagen die Leute, ‚er soll gesund sein, hübsch und erfolgreich‘“. Das allerdings sind Eigenschaften, die nicht an einem einzelnen Gen hängen, sondern wahrscheinlich an Tausenden oder Millionen Varianten unseres Genoms. Das induzieren zu wollen, sei völlig unrealistisch.
Ein paar Kilometer nördlich vom Virchow-Klinikum, im Max-Delbrück-Center am Stadtrand von Berlin, schaut Helena Escobar, eine Frau im gelben Laborkittel und mit blauen Gummihandschuhen, in ein Mikroskop. Escobar arbeitet an einer anderen Form der medizinischen Genmanipulation, einer sogenannten Zell-basierten Gentherapie. Statt das Erbgut grundsätzlich zu verändern, werden dabei kranke Zellen entnommen, korrigiert und dann wieder injiziert. Escobar konzentriert sich dabei auf bisher unheilbare Muskeldystrophien. Dabei verlieren die Patienten nach und nach ihre Muskelkraft, wobei nicht nur das Gehvermögen, sondern auch die Atmung und das Herz betroffen sein können. Mit einer Injektion von Zellen, in denen Escobar den genetischen Defekt behoben hat, könnte man die Erkrankung theoretisch aufhalten. Bei Mäusen, sagt Escobar, funktioniere das schon: „Aber auch diese Methode braucht Zeit“, so die Forscherin, als sie die Proben wieder in einen temperierten Schrank zurückstellt. „Noch können wir nicht sagen, wann wir damit Krankheiten heilen können.“ Ein großer Teil von Escobars Analysen findet dabei mittlerweile nicht mehr „in vitro“ (in der Petrischale) oder „in vivo“ (im Lebenden) statt, sondern „in silico“ – auf Computern. Ohne IT, so Escobar, wäre es schwierig, das Erbgut zu analysieren und die passenden Reparaturmoleküle für das CRISPR-Verfahren zu finden.
In der Medizin geht es an den Rändern des Machbaren aber nicht mehr nur um das klassische Heilen im Sinne von reparieren, was nicht funktioniert, sondern auch darum, zu ersetzen. Manchmal sogar mit ganz neuen Teilen.
Druck dir deine Organe selbst
Lutz Kloke, Gründer des Bioprinting-Startups Cellbricks, sitzt in einem Konferenzraum auf dem alten AEG-Campus im Berliner Norden und spielt die Anfangsszene von Alien Covenant auf einem Beamer ab. Der Android David 8 wurde dort gerade gedruckt. „Da möchte ich hin. Irgendwann“, sagt Kloke und lächelt. Er trägt Dutt und Drei-Tage-Bart. Die Idee ist, Lebern und Nieren nicht mehr aus fremden Körpern transplantieren zu müssen. Vorausgesetzt, es gibt überhaupt einen Spender. „Du konstruierst ein CAD-Modell von dem Objekt, das du bauen willst. Beispielsweise eine Leber“, beschreibt Kloke seine Vision. „Dafür schaust du dir die Physiologie des Körpers an, und guckst: Was ist die kleinste funktionelle Einheit des Organs, die mich interessiert? Dann besorgst du dir die Zellen, die du dafür brauchst und steckst sie in einen Brutschrank, damit sie sich teilen, bis du genug Druckmaterial für dein Organ hast.“
Ganz so weit sind Kloke und sein Team aber noch nicht. Er legt eine Petrischale vor sich auf den Konferenztisch, darin ist eine fingernagelgroße, milchig wirkende Masse zu erkennen. Wenn man genau hinschaut, sieht man darin rote Äderchen: „Unser bestes Gefäßsystem“, sagt er. Dank der Äderchen können Klokes Zelldrucke auch versorgt werden, das ist das Besondere daran. Außer an Leberzellen bastelt Cellbricks gerade an Knorpeln, Plazentas, Kieferknochen und Tumormodellen für die Forschung der Charité.
Lutz Kloke prüft im Labor gedruckte Zellen. Im Gegensatz zu den oft unterschiedlichen, herkömmlichen Zellproben kann Kloke identische Objekte für die Tests der Industrie drucken. Für echte, transplantable Organe, so Kloke, fehlen noch ein paar Millionen Euro Risikokapital. (Foto: t3n)
Klokes Biodrucker steht eine Etage tiefer im Labor und sieht aus wie ein Wohnzimmeraquarium mit schwarzer Rückwand. Das Verfahren, mit dem Kloke druckt, nennt sich Stereolithografie: Der Druckkopf wird in wechselnde Bioink-Schälchen getaucht und von unten belichtet, sodass sich einzelne Schichten Zellen an ihm ablagern. Dann wird das Objekt wieder aus der Flüssigkeit gezogen. Die Drucke verkauft Cellbricks für die Forschung an Universitäten oder für Medikamententests an die Industrie. Gleich neben Klokes Labor liegt das Büro von Tissuse. Eine Firma, die für die Arbeit mit Zellstrukturen – wie die von Cellbricks – sogenannte Organchips baut: Platinen, auf denen statt Computerchips kleine Zellstrukturen miteinander verbunden werden können. Den Vier-Organ-Chip von Tissuse könnte man beispielsweise mit Leber, Nierenzellen, Darmzellen und etwas Blut zum Versorgen befüllen. Forscher können damit Medikamente nicht nur an einem Zellhaufen testen, sondern an einem System von verschiedenen Zellen. Kloke will bald mit seinem Onlineshop live gehen: „Dann kannst du deine Miniorgane bei uns bestellen, und wir liefern sie dir. Erst mal nur in Deutschland, dann in der DACH-Region. Organisch wachsen.“ Er grinst.
Aber Cellbricks will mehr als ein Onlinehändler für Testzellen sein, Kloke und sein Team wollen auch selbst Transplantate herstellen: „Ein autologes Organ aus einer Eigenzellspende von dir“, sagt er. Mit ein paar Millionen Euro Venturecapital, glaubt Kloke, sei das machbar. „Wenn das kosmetisch geht, kommt hoffentlich der Schritt, dass man etwas bauen kann, was lebenserhaltend ist. Leber, Herz, Nieren, Lunge. Die großen Organe. Nicht nur Haut, Knochen, Knorpel. Das ist die Vision, die uns antreibt. Ich möchte was Transplantables bauen.“
In den USA gibt es schon den ersten Forscher, der transplantierbare Blasen ausgedruckt hat. Eine Handvoll Patienten laufen damit herum. Abgesehen davon hat noch nichts funktioniert. Die eigentliche Herausforderung beim Biodruck ist die Komplexität des menschlichen Körpers. Man könne zwar nierenförmige Objekte aus Nierenzellen drucken, so Kloke, aber noch nicht in einer so komplexen Struktur, dass sie auch wirklich funktionierten. „Eine komplette Leber ist noch zu komplex“, erläutert der Experte.
Wenn man Kloke fragt, wo die Grenzen der neuen Medizin liegen, wird er nachdenklich. Wenn Cellbricks ein Erfolg wird und er junger Bioprinting-Millionär, wie weit ließe sich so ein Leben ausdehnen? Können wir bald alles heilen oder nachdrucken? Werden wir unsterblich? „Unsterblich nicht. Aber sehr alt. Mit viel Geld, und wenn man Forschung in diesem Bereich stark unterstützt“, sagt er. Dann hellt sich seine Miene auf. „Aber ich finde es gar nicht schlecht, irgendwann zu sterben. Unsere Gesellschaft ist noch nicht darauf vorbereitet, dass wir plötzlich 40 Jahre länger leben – Rente, Versicherung, Familie sind noch nicht bereit dafür, dass ein 150jähriger mit am Tisch sitzt. Außerdem hat sich die Evolution gewissermaßen ja auch eine Technik der ‚Unsterblichkeit‘ ausgedacht: Meine Tochter ist auch 50 Prozent ich. Und ich finde diese Technik ganz charmant.“
Irgendwie scheint die große Frage, die bei Lutz Kloke, den Mikroroboterforschern aus dem Max-Planck-Institut und Genforschern im Raum steht, weniger das Wie zu sein als das Wann. Technisch vorstellen kann man sich so Einiges. Lutz Kloke antwortet auf die Wann-Frage: „Ich bin mir relativ sicher, dass wir beide jung genug sind, um mitzukriegen, wie gedruckte Transplantate in den medizinischen Kanon eingehen.“ Mettin Sitti hofft immerhin, dass er seine Mikroschwimmer noch in Aktion sehen wird, bevor er in Rente geht. Zwar machen Biotechnik und Medizin dank der Fortschritte auf dem Gebiet der IT gewaltige Sprünge, die uns den menschlichen Körper und seine Komplexität etwas besser verstehen lassen. Doch mit jedem Sprung tauchen eben auch neue Probleme auf. „Wir denken immer, wenn wir eine Technologie haben, dann ist das Problem gelöst“, beschreibt es Lutz Kloke. „Aber du kannst nicht ein paar Millionen Jahre Evolution überholen, nur weil du es geschafft hast, einen Drucker zu bauen. Die Natur ist viel komplexer, als du es dir vorstellen kannst. Wir begreifen viele Sachen ja gar nicht im Detail.“

