Food-Tech: Wie Startups klimafreundliche Burger heranzüchten

2013 hat Mark Post den ersten In-Vitro-Burger vorgestellt.
Larry Page von Google hatte investiert. Heute arbeitet der Gründer in Maastricht mit seiner Firma Mosa Meat an Laborfleisch der Zukunft. (Foto: Mosa Meat)
Ein schneller Griff in den Eisschrank und Mazen Rizk hält eine 300 Gramm schwere Masse in der Hand. Leicht bräunlich schimmert sie durch eine teils vereiste Plastiktüte hindurch. Ja, so etwa könnte Fleisch aussehen. Aber was der 34-Jährige eine „aufwendige Biomasse“ nennt, ist ein pflanzlicher Zellhaufen, mit dem er den Markt der Fleischersatzprodukte aufmischen will.
Genauer gesagt: Es sind Pilzzellen, die der Gründer von Mushlabs in einem Hamburger Labor herangezüchtet hat. Mit unterschiedlichen Kohlenhydraten und Eiweißen hat Risk sie gefüttert, Temperaturen und pH-Werte variiert, um dem Nährgehalt von Fleisch Konkurrenz zu machen: „Darin sind jetzt Proteine, Ballaststoffe, Vitamine und diverse Mineralstoffe“, sagt Rizk. Viel darüber verraten, wie er die Zellmasse in ein fertiges Gericht verwandeln möchte, könne er noch nicht. Nur so viel: „Das könnte dann eine Frikadelle sein oder auch etwas ganz anderes.“
Mushlabs ist eine von vielen Firmen, die neu definieren wollen, wie wir uns in Zukunft ökologisch und gesund ernähren können. Zu nennen sind zum Beispiel das milliardenschwere US-Startup Beyond Meat, das ebenfalls aus Kalifornien stammende Impossible Foods oder Mosa Meat aus den Niederlanden. Ginge es nach ihnen, würden wir schon bald viel weniger Tiere halten und schlachten. Denn heute gehen 14,5 Prozent der vom Menschen verantworteten klimaschädlichen Treibhausgase auf das Konto tierischer Produkte, so die Berechnug der Welternährungsorganisation. Nehmen wir das Beispiel Rindfleisch: Da wird Regenwald für Sojapflanzen gerodet, die um die halbe Welt geschifft werden, um hier Kühe zu füttern, die mit ihrem Methanausstoß zusätzlich den Klimawandel beschleunigen.

Mazen Rizk von Mushlabs versucht mithilfe von Pilzzellen eine fleischähnliche Substanz herzustellen. (Foto: Jonas Gerding)
Tüftler und Chemiker wollen deshalb Fleischersatzprodukte ohne Nebenwirkungen schaffen. Vordergründig geht es darum, wer den rauchigen Geschmack eines Bratlings am besten imitieren kann – im Hintergrund geht es um Technologie, niedrige Herstellungskosten und viel Geld. Die Lebensmittelbranche hofft auf einen wachsenden Markt: Sie will nicht nur tierliebende Vernunftkäufer, sondern auch Genussmenschen locken, öfters in einen veganen Burger oder eine fleischfreie Salami zu beißen.
Der Hype um den auch bei deutschen Discountern so schnell ausverkauften Burger von Beyond Meat zeigt wieder einmal, wie früh der Megatrend bereits im Silicon Valley gepusht wurde. Wer sich bei den Startups hierzulande umhört, lernt, was es braucht, um Ernährung neu zu denken: ein top ausgestattetes Labor und wahrhaftigen Pioniergeist. Denn: Wer zu viel mit Zusatzstoffen trickst, um den blutigen Geschmack von Fleisch zu imitieren, der kann Kunden vergraulen, denen Natürlichkeit und Gesundheit wichtig sind. Oft müssen sich Gründer mit Behörden herumschlagen und nicht ganz unberechtigten Fragen stellen wie der, ob In-Vitro-Fleisch nun eigentlich als echtes Fleisch deklariert werden darf. Und nicht zuletzt ist da noch ein unterschätzter Wettbewerber im Rennen um die bessere Ökobilanz: Hühnerfleisch.
Rizk hat einen anderen Blick auf Lebensmittel. Für ihn ist auch Fleisch am Ende nichts anderes als ein Zellhaufen, nur eben in seiner Zusammensetzung etwas anders als das tierfreie Laborprodukt, das er präsentiert. Bereits für seine Doktorarbeit hat sich der studierte Molekularbiologe mit Zellen beschäftigt. Experimentierte er damals noch an den Bedingungen für Enzyme bei der Produktion von Biokraftstoffen, geht es ihm heute um die Umstände für seine Pilzzellen: „Bekommen die Zellen zu wenig zu essen, denken sie, dass sie erst einmal Proteine wachsen lassen müssen“, beschreibt er einen der vielen Faktoren, mit denen er Geschmack, Nährwerte und Konsistenz des Endprodukts beeinflussen will. „Gibt es zum Beispiel Ethanol, heißt es für die Pilzzellen, dass Gefahr droht und sie sich eine dickere Zellwand zulegen müssen. Das sind so die exciting Sachen für uns“, sagt Rizk, der auf der Suche nach den passenden Worten hin und wieder im Englischen fündig wird. Er kam erst vor neun Jahren aus dem Libanon nach Deutschland.
Heute gehen 14,5 Prozent der vom Menschen verantworteten klimaschädlichen Treibhausgase auf das Konto tierischer Produkte.
Vor ihm auf der Arbeitsplatte reiht er Petrischalen auf. Ganz links eine, in der nichts als der zähflüssige hellbraune Nährboden aufgebracht ist. In der rechts davon sprießen bereits ein paar weiße Pilze. Die dritte Schale füllt der flauschige Pilz komplett aus, ähnlich eines unliebsamen Schimmels, der sich ausgebreitet hat. Völlig unbedenklich sei der jedoch, versichert der Unternehmer. Welche Pilzsorte sich hier ausbreite, das müsse er vor der Konkurrenz geheim halten. Aber es seien Zellen aus der Wurzel eines handelsüblichen Esspilzes.
Die Proben werden entnommen und in zwei weiteren Laborräumen kräftig zum Wachsen gebracht. Bei erhöhten Temperaturen schüttelt ein Inkubator mehrere Glaskolben, in denen die Pilze in Flüssignahrung schwimmen. Schließlich übernehmen mechanisierte Fermenter, wo die Pilze in bis zu 15-Liter-Mischungen gedeihen. Aus der Pilzschwemme wird dann einer jener von Rizk präsentierten fleischähnlichen Massen, die er marktreif bekommen will: „Entweder wir kriegen den Prozess schneller hin oder bekommen eine höhere Ausbeute“, erklärt er den Spagat zwischen Kosteneffizienz und dem begehrten Proteingehalt. Bei 35 Prozent würde er schon heute nach weniger als zwei Wochen liegen.
Geschmacksverstärker als Geschäftsrisiko
Tatsächlich ist es so, dass ein schnödes Naturtofu mit einem geringen Eiweißanteil heute schwer neue Kundengruppen überzeugt: „Wir erleben eine Mentalitätsumstellung“, sagt Katya Witham, die für das britische Marktforschungsinstitut Mintel den deutschen Markt beobachtet. „Verbraucher essen vermehrt pflanzliche Produkte, setzen sich mehr mit dem eigenen Konsum auseinander und fragen gleichzeitig auch, was für ihre Gesundheit besser ist, ohne dabei komplett auf Fleisch zu verzichten.“ Zwischen dem Jahr 2013 und 2018 haben Supermärkte in Deutschland die Einführung von veganen Produkten in ihr Sortiment mehr als verdreifacht, haben Marktforscher ermittelt.
Selbst traditionsreiche Größen der Fleischbranche wie Rügenwalder und Wiesenhof haben Fleischersatzprodukte für sich entdeckt. Das ist jedoch eher ein Kulturwandel als technologische Revolution: Sie nutzen etablierte Verfahren, um aus Soja oder Weizen pflanzliche Proteine zu extrahieren. Mit allerlei Zusatzstoffen vermengt, macht es für sie keinen Unterschied, ob am Ende eine tierische oder pflanzliche Leberwurst, Salami und Lyoner durch ihre Produktionsstraßen laufen. Auch der Burger von Beyond Meat hat seinen Erfolg vor allem dem selbstbewussten Marketing, dem ausgewogenen Aroma und der blutigen Rote-Beete-Beimischung zu verdanken. Er basiert auf gewöhnlichen Erbsenproteinen, die Zutatenliste ist recht lang.
Mushlabs ist aus technologischer Perspektive weitaus innovativer, hängt aber in der Produktentwicklung noch hinterher. Die Entscheidung, wie die herangezüchteten Pilzzellen nun weiterverarbeitet werden, sei noch nicht gefallen, sagt Mazen Rizk: „Da brauchen wir klar die Hilfe von Lebensmitteltechnologen, um zu sehen, wie das dann überhaupt schmeckt.“
Auf die Frage des massentauglichen Geschmacks folgt heute noch eine lange Pause. „Miso“, lautet dann seine knappe Antwort, die durchaus Sinn ergibt: für japanischen Miso-Suppen braucht es die Gärung von Koji-Schimmelpilzen. „Das geht in Richtung Fleisch“, schiebt Rizk hinterher. Er entsperrt sein Smartphone und wischt durch eine Bildergalerie von Fleischersatzgerichten, mit denen sie bereits in der Küche experimentiert haben.
„Was essen die Deutschen überhaupt?“, sagt Rizk über seine „funktionale“ Herangehensweise. „Wurst ist ihnen möglicherweise wichtiger als Burger“, glaubt er. Welche Produkte es genau sind, das möchte er noch nicht mit der Öffentlichkeit teilen. Für das kommende halbe Jahr stehen deshalb erst einmal Marktforschungen an, Kooperationen mit Lebensmitteltechnikern und das Testen von Prototypen. Innerhalb des kommenden Jahres will das Unternehmen ein erstes Produkt auf den Markt bringen. Die Gründer denken über den Einzelhandel und Restaurants nach. Aber auch da ist noch vieles offen. Aus eigener Erfahrung weiß Rizk, mit welchen Tricks sich Nahrung aufpeppen lässt. Nach seiner Promotion hat er in der Forschungsabteilung eines Lebensmittelkonzerns gearbeitet, der mit Hefeextrakten wirbt, die Produkten die perfekte Fleischnote verpassen soll.
Wie alle Player der Branche steht auch er vor einer folgenschweren Abwägung: Kunden mit der Natürlichkeit eines Produkts überzeugen oder Fleisch möglichst imitieren – und dafür zu ausgeklügelten Zusatzstoffen greifen? „So wenig wie möglich oder keine“, lautet seine heutige Antwort auf die Zusatzstoffe. „Wir haben ein Benchmark, und das ist Fleisch mit seinen Nährstoffen und Proteinen“, sagt er. „Nur, dass wir noch Ballaststoffe einbringen können.“
Damit scheint er im Trend zu liegen: „Wir sind heute viel wissensorientierter, schauen auf Labels, Inhaltsstoffe und haben eine Abneigung gegen alles, was künstlich ist“, sagt die Marktforscherin Witham. Im Juni 2016 veröffentlichte die Stiftung Warentest eine Prüfung von 22 gängigen Fleischersatzprodukten. Fast jedes zweite Produkt erhielt ein „mangelhaft“ oder „ungenügend“. Die Lebensmittel seien überwürzt, enthielten teilweise sogar Mineralölrückstände. Die Branche bekam Berichte dieser Art zu spüren, belegen Daten von Mintel. Im Juli 2017 gaben 15 Prozent der von ihnen befragten Verbraucher in Deutschland an, in den letzten drei Monaten Fleischersatzprodukte gekauft zu haben. Ein Jahr später waren es nur noch zehn Prozent. „Nach dem riesigen Boom ließ die Anzahl der Produkteinführungen erst einmal nach“, sagt Witham.
Da mag allein schon die Frage absurd klingen: Aber könnte ausgerechnet noch mehr Food-Tech aus dem Labor das ersehnte Superprodukt liefern, das ohne Tierleiden auskommt, ökologisch ist und gleichzeitig auch noch natürlich und gesund? Warum nicht gleich die Zellen von echten Tieren vermehren lassen, um eine Fleischkopie auf die Teller zu zaubern, die ohne das Gepansche mit Geschmacksverstärken auskommt?
Landwirtin mit Labor
Mark Post hat im Jahr 2013 der Weltöffentlichkeit den ersten In-Vitro-Burger vorgestellt, gefördert von Google-Gründer Sergey Brin und entwickelt an der Universität von Maastricht, wo heute Brins Firma Mosa Meat sitzt. In Deutschland ist es ein Team um Laura Gertenbach, das nach eigenen Angaben das erste Laborfleisch herstellen will. Der Weg dahin jedoch ist lang und steinig.
Gertenbach ist gelernte Wirtschaftswissenschaftlerin und Informatikerin. Die 35-Jährige hält in der Nähe von Rostock edle Weiderinder der Rassen Angus und Galloway Hochland, die sie nicht mit dem letzten Transport ins Schlachthaus quälen möchte, sondern auf der Weide tötet. Sie versteht etwas von Verarbeitung, Vermarktung und der Frage, was den Geschmack von hochwertigem Fleisch eigentlich definiert. Einer ihrer beiden Mitstreiter kommt aus der Pharmaindustrie, ein Fachmann im Bereich Zelltherapie, auf die die Idee der Multiplikation von Stammzellen zurückgeht, die ursprünglich für die Transplantation von Organen gedacht war.
„Wir sind große Puzzler“, sagt sie. Die eine etablierte Methode gebe es nicht, höchstens Ansätze verschiedener Disziplinen, die sie in viele Herstellungsschritte übertragen wollen. Mit Investoren diskutieren sie gerade den Plan, mit dem sie in zwei, drei Jahren ihre Version des In-Vitro-Fleischs umgesetzt haben wollen. Auch ein Labor in Rostock wartet bereits darauf, bestückt zu werden. „Wir müssen jetzt beweisen, dass das Ganze auch funktioniert“, sagt Gertenbach.
Gleich zu Beginn wird es knifflig werden. Woher die Zellen nehmen? Die erste Option: Aus toten Tieren herausschneiden. Damit ließe sich das Laborprodukt am einfachsten als echtes Fleisch vermarkten. Denn laut Definition im Bundesanzeiger muss es immer von geschlachteten oder erlegten Tieren kommen. Die zweite Option: die sogenannte Stanzbiopsie, die Entnahme einer kleinen Probe mit einer Art Spritze aus lebendigen Kühen. „Das geht nur unter sehr strengen Auflagen, weil es als Tierversuch gilt“, sagt Gertenbach. „Na ja, langfristig wären wir da wohl bei der Stanzbiopsie, sonst können wir es ja nicht ,Innocent Meat‘ nennen“. So lautet der Name des Startups. Eine schwierige Gratwanderung hat die Gründerin da vor sich: Einerseits ein Produkt als unschuldig vermarkten, andererseits beispielsweise Gehacktes im Labor kreieren, das ganz selbstverständlich hinter der Fleischtheke liegt – und dafür möglicherweise vom toten Tier kommen muss.
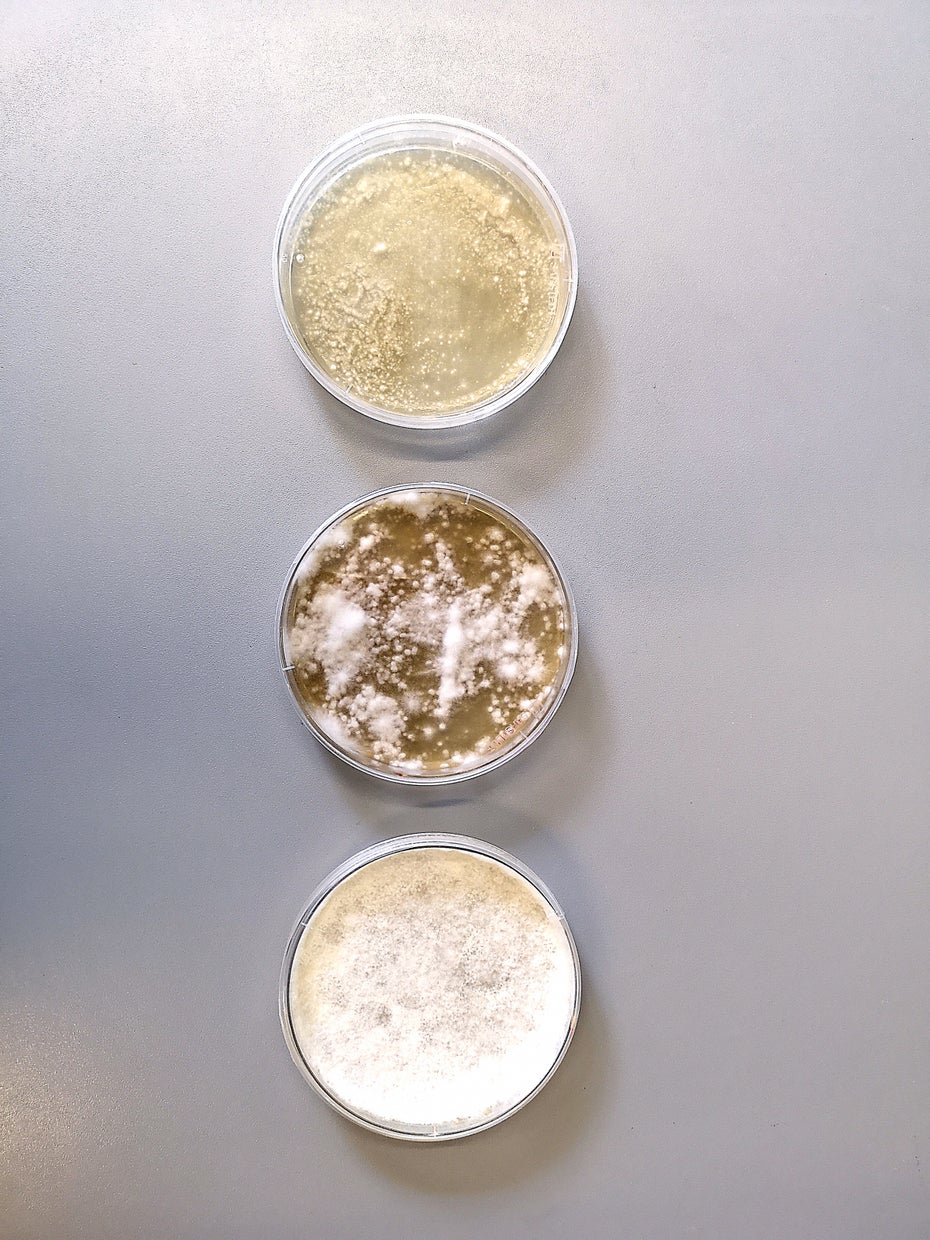
Pilzkulturen aus dem Mushlabs-Labor: „Bekommen die Zellen zu wenig zu essen, denken sie, dass sie erst einmal Proteine wachsen lassen müssen.“ (Foto: Jonas Gerdig)
Wie auch bei Mushlabs Pilzzellen bräuchte es dann noch ein Nährmedium, mit dem die Zellen gefüttert werden. Insbesondere in der Entwicklungsphase ist das oft das umstrittene Kälberserum, das nach der Schlachtung einer tragenden Kuh aus dem Herzen des ungeborenen Fötus entnommen wird. Immerhin: Startups wie Meatable aus den USA zeigen schon heute, dass sich das Nährmedium auch durch künstlich produzierte Alternativen ersetzen lässt. Mit dem Wachstum der Zellen häufen sich auch die Herausforderungen: Damit tierische Zellen sich überhaupt vermehren, muss tief in die biologische Trickkiste gegriffen werden. Bei den der US-amerikanischen In-Vitro-Pionieren von Memphis Meats sorgt dafür Crispr/Cas. „Das ist total elegant, aber auf dem europäischen Markt schwierig“, sagt Gertenbacher. Die Genschere gilt seit einem Urteil des Europäischen Gerichtshofs als Genmanipulation und ist somit hierzulande nur unter strengen Auflagen möglich. Wie genau Innocent Meat es anstellen will? Geschäftsgeheimnis.
Im weiteren Verlauf braucht es ein spezielles Gerüst, auf dem das Fleisch zu Fasern wächst, eine ausgeklügelte Nährstoffversorgung sowie Methoden, um Giftstoffe zu entfernen und Schimmel zu vermeiden. Für das authentische Aroma will die Fleischkennerin das Prozedere nicht nur mit Muskelzellen durchlaufen, sondern auch für das nötige Fett. „30 Prozent Fettanteil“, sagt sie, „das wäre für meinen Geschmack ein gutes Verhältnis.“
Geflügelte Gegenspieler
Sergiy Smetana interessiert sich nicht dafür, welche Sinneseindrücke Lebensmittel hinterlassen. Ihm geht es um den ökologischen Fußabdruck, der zurückbleibt. Der Umweltökologe am deutschen Institut für Lebensmitteltechnik in Osnabrück ist Experte darin, in Lebenszyklusanalysen den Umwelteinfluss zu berechnen, den Produkte von der Herstellung bis zum Konsum verantworten. In einer im Juli 2015 veröffentlichten Studie nahm er sich Fleischersatzprodukte vor – und verglich sie mit Hühnchen.
Als er die Daten zusammentrug, habe er für das Laborfleisch noch Hochrechnungen anstellen müssen, schränkt er ein: „Aber, die ökologischen Auswirkungen von Laborfleisch sind sehr massiv“, lautet sein Fazit. „Das haben auch darauffolgende Studien bestätigt.“ Vor allem ist es der extrem große Energieverbrauch, der für die vergleichsweise schlechte Ökobilanz sorgt. Zu den Aspekten, die Smetana in seine Rechnungen packt, gehören auch die Nutzung von landwirtschaftlichen Flächen, die Belastung von Böden, Gewässern und der Einfluss auf den Klimawandel.
Auch den ökologischen Fußabdruck für ein Produkt auf Pilzbasis hat Smetana durchkalkuliert. Mit einem ernüchternden Ergebnis. Er ist gleichauf mit dem Hühnerfleisch. „Es wird oft übersehen“, sagt Smetana, „aber Hühnchen ist überraschend gut im Vergleich von Ressourcenverbrauch.“ Proteine aus Insekten schneiden noch etwas besser ab. Der Umweltgewinner ist laut Smetana aber die Fleischalternative aus Soja, die mit einer doppelt so guten Umweltbilanz brilliert: „Soja ist wahnsinnig effizient“, so der Umweltökologe, „trotz des Transports über tausende Kilometer.“
Damit tierische Zellen sich überhaupt vermehren, muss man tief in die biologische Trickkiste greifen.
Den Verfechtern des ungezügelten Fleischkonsums will er jedoch nicht allzu weit entgegenkommen: Hätte er statt Geflügel die Verbrauchswerte von Schweinefleisch herangezogen, würden die Veggie-Optionen sogleich etwas besser dastehen. Das gilt erst recht für Rind und Schaf, deren ökologischer Fußabdruck um ein Vielfaches gravierender ist als der von Hühnchen.
Smetanas Studie war zudem eine Momentaufnahme, die kommende Effizienzsteigerungen nicht berücksichtigt. Dieser Punkt ist auch Gertenbach wichtig: „Wenn wir den Energieverbrauch mit herkömmlichem Fleisch vergleichen, ist das positiver“, sagt sie über Rindfleisch, ihren Referenzwert. Aber auch sie kann vorerst nur auf eigene Hochrechnungen verweisen – und ein betriebswirtschaftliches Argument für mehr Effizienz: „Letztlich muss man den Strom ja auch zahlen“, sagt sie.
Wie rasant der technologische Fortschritt ist, spiegelt sich auch in den Preisen bei den Wettbewerbern wider. Etwa 250.000 Euro habe allein der Prototyp von Mosa Meat noch gekostet. Die Energiebilanz wird dementsprechend desaströs gewesen sein. Nun will das niederländische Startup im Jahr 2020 mit hochskalierten In-Vitro-Produkten auf den Markt gehen, die für etwa neun Euro im Regal stehen könnten. Ob auch Innocent Meat langfristig mit dem Fleisch im Supermarkt konkurrieren kann? „Das ist aus meiner Sicht schon möglich “, sagt Gertenbacher.



Bitte beachte unsere Community-Richtlinien
Wir freuen uns über kontroverse Diskussionen, die gerne auch mal hitzig geführt werden dürfen. Beleidigende, grob anstößige, rassistische und strafrechtlich relevante Äußerungen und Beiträge tolerieren wir nicht. Bitte achte darauf, dass du keine Texte veröffentlichst, für die du keine ausdrückliche Erlaubnis des Urhebers hast. Ebenfalls nicht erlaubt ist der Missbrauch der Webangebote unter t3n.de als Werbeplattform. Die Nennung von Produktnamen, Herstellern, Dienstleistern und Websites ist nur dann zulässig, wenn damit nicht vorrangig der Zweck der Werbung verfolgt wird. Wir behalten uns vor, Beiträge, die diese Regeln verletzen, zu löschen und Accounts zeitweilig oder auf Dauer zu sperren.
Trotz all dieser notwendigen Regeln: Diskutiere kontrovers, sage anderen deine Meinung, trage mit weiterführenden Informationen zum Wissensaustausch bei, aber bleibe dabei fair und respektiere die Meinung anderer. Wir wünschen Dir viel Spaß mit den Webangeboten von t3n und freuen uns auf spannende Beiträge.
Dein t3n-Team
Pilze sind aber keine Pflanzen. Pilze bilden ein eigenes Reich, das mit Tieren näher verwandt ist als mit Pflanzen.
Hallo, ein entscheidener Faktor bei der Züchtung im Nährmedien wurde unterschlagen.
Für das Nährmedien benötigt man Zellen die aus EMBRIOS die BEI DER SCHLACHTUNG SCHWANGERER Kuhe gewonnen werden. Es handelt sich also beim Zellfleisch aus den USA um Etikettenschwindel.
Pilze sind keine Pflanzen. Im ersten Abschnitt so einen Fehler. Und euch soll ich abonnieren? :D