
Im übernächsten Schritt könnte die Methode am Menschen gestestet werden.
(Bild: JLStock / Shutterstock.com)
Von einer bahnbrechenden Studie sprechen Beobachter, wenn sie über die neuste Arbeit von Jing Wang und seinem Team an der New York University Grossman School of Medicine berichten. Über das interdisziplinäre Schmerzforschungsprogramm der New York University Langone banden sie weitere Fachkräfte der Neurowissenschaften ein. Die Schmerzmediziner entwickelten ein Brain-Machine-Interface (BMI) mit einem geschlossenen Regelkreis, um Schmerz aufzuspüren und zu bekämpfen.
Der anteriore cinguläre Cortex (ACC). (Bild: Geoff B Hall, CC0)
So funktioniert das Brain-Machine-Interface
Die Arbeitsweise des Systems ähnelt der des Gehirns: Ein Teil identifiziert Aktivität in einer bestimmten Region, eine Schaltstelle verarbeitet die Information und stimuliert daraufhin einen anderen Bereich. Der Implantat-Prototyp besitzt ein Array von Elektroden im anterioren cingulären Cortex (ACC), also einem Teil der Großhirnrinde. Die Anordnung erkennt bestimmte elektrische Muster im ACC, die mit Schmerzempfindung verbunden sind. Ein implantierter Chip übernimmt die Aufgabe der Schaltstelle: Er wertet die Signale aus und reagiert. Wenn er Schmerz erkennt, aktiviert er eine Stimulation des prälimbischen präfrontalen Cortex (PFC). Versuche hatten gezeigt, dass das den Schmerz dämpft. Diese Abfolge passiert so schnell, dass die Mediziner von „Echtzeit“ sprechen. Dieses System könnte in Zukunft besonders chronischen Schmerzpatienten helfen, die bereits unempfindlich auf die Behandlung mit herkömmlichen Schmerzmitteln reagieren. Die Erkenntnisse stellen zwar einen Durchbruch dar, die Technologie steht jedoch erst am Anfang und wurde bisher nur an Nagetieren getestet.
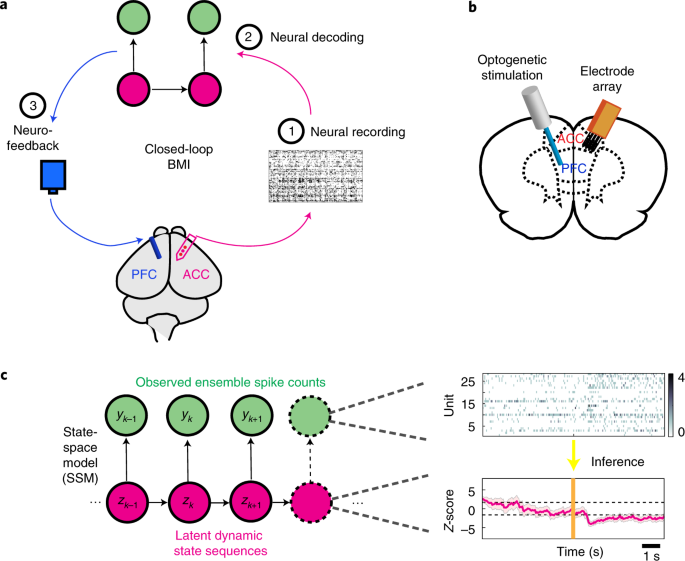
In einer Grafik stellen die Forscher ihr Brain-Machine-Interface dar. (Grafik: NYU Grossman School of Medicine)
Geschlossener Kreislauf „spekulativ“
„Unsere Ergebnisse zeigen, dass dies eine effektive Strategie für die Schmerztherapie bietet, selbst in Fällen, in denen die Symptome traditionell schwer zu lokalisieren oder zu handhaben sind“, erklärt Wang. Doch dahin war es ein weiter Weg. Zuerst stand das Team vor der Herausforderung, dass Schmerz im Gehirn – im Gegensatz zu motorischen Bewegungen etwa – generell schwer zu lokalisieren ist. Es implantierte zu diesem Zweck die Elektrodenanordnung im ACC und experimentierte damit. Die Versuche zeigten, dass bestimmte Muster in 80 Prozent der Fälle auftraten, in denen Versuchstieren Schmerzen zugefügt worden waren. So standen die Forscher vor der nächsten Herausforderung: Die Verknüpfung des Gehirns mit sich selbst. Anstatt über die decodierten Signale ein externes System (etwa eine Anzeige) zu steuern, wollten sie über diese wiederum einen internen Bereich aktivieren. Es gibt Handprothesen, die das bereits können: Elektrische Stimulatoren übertragen dabei unter anderem Druck- und Temperaturempfindungen an verbleibende Nerven. Das Gehirn entschlüsselt die Signale und sendet über andere Nervenbahnen Befehle zurück, um die Hand zu steuern. Neurowissenschaftler sprechen von einem Closed-Loop-System. Das Team von Jing Wang konstatiert, die Verwendung von Closed-Loop-Gehirnimplantaten sei „höchst spekulativ“.
Keine Sucht- und Gewöhnungsfolgen
Einen „Eingangsarm zur Signalerkennung“ hatten sie nun schon: den ACC, der nachweislich Schmerzen bei Mensch und Tier verarbeitet. Nun mussten sie sich für den „Ausgangsarm zur Behandlung“ entscheiden. Früheren Studien hatten gezeigt, dass die Stimulation von PFC-Neuronen Schmerzsignale aus dem ACC lindern kann. Wenn der ACC ein weinendes Kind darstellt, das sich den Zeh gestoßen hat, ist der PFC das Elternteil, das darüber hinwegtröstet. Die Behandlung fand über eine optische Faser statt, die PFC-Neuronen stimuliert. Die Glasfaser nutzt Optogenetik, eine Methode, die Licht zur Steuerung genetisch veränderter Neuronen einsetzt. Zusammen stellt das System eine Echtzeit-Rückkopplungschleife dar, die Schmerz unterdrückt, sobald er auftaucht. Ein großer Vorteil dabei liegt darin, dass die PFC-Stimulation keine Euphorie hervorruft, wie etwa Opioide, und damit die Abhängigkeitswahrscheinlichkeit senkt. Durch die punktuelle Linderung gewöhnt sich das Gehirn auch nicht so leicht daran, ein Gewöhnungseffekt wird also unwahrscheinlicher.
Nager zeigen Linderung
Die Wissenschaftler testeten ihr System für plötzlichen akuten Schmerz. Die Studie errechnete eine Schmerzvertreibung von 40 Prozent. Auch mechanische und chronische Schmerzen – etwa im Zuge von Entzündungen wie Arthritis – wurden erfolgreich gemindert. Zuletzt konnten sie neuropathische Schmerzen, also durch überempfindliche Nerven und Sensoren, mit der Methode lindern. Die Autoren der Studie sprechen von einer „Blaupause“ für kommende Schmerztherapien.
Auf der anderen Seite liegt noch ein langer Weg vor einem Einsatz beim Menschen. Der ACC sei ein Hauptbahnhof für allerlei Empfindungen und habe weitreichende Verbindungen in andere Hirnregionen. Neben der Schmerzverarbeitung werden ihm Funktionen wie Empathie, Entscheidungsfindung und soziales Verhalten zugesprochen. „Da wir derzeit keine spezifischen anatomischen Ziele für die Schmerzbehandlung haben, werden die meisten Hirnregionen […] unweigerlich unspezifische Effekte haben“, so die Autoren.

